مؤلف:
John Pratt
تاريخ الخلق:
17 شهر فبراير 2021
تاريخ التحديث:
26 يونيو 2024

المحتوى
- لتخطو
- طريقة 1 من 2: حساب الكتلة المولية للعنصر
- طريقة 2 من 2: حساب الكتلة المولية لمادة مركبة
- نصائح
- تحذيرات
- الضرورات
الذرات صغيرة جدًا لإجراء قياسات ذات مغزى للمواد الكيميائية. لكي تكون قادرًا على العمل بكميات صغيرة جدًا من مادة معينة ، يتم تصنيفها من قبل العلماء في وحدات مول. يُعرَّف الخلد بأنه كمية معينة من المادة تحتوي على العديد من الجسيمات مثل عدد ذرات الكربون في 12 جرامًا من نظير C-12 ، وهو ما يعادل تقريبًا 6.022 14 × 10. وهذا ما يسمى رقم Avogadro أو ثابت. يتم استخدامه للإشارة إلى عدد الذرات أو الجزيئات أو الأيونات أو الجسيمات دون الذرية في أي مادة ، وكتلة 1 مول هي الكتلة المولية لتلك المادة. يمكنك هنا قراءة كيفية حساب الكتلة المولية للعناصر والمواد.
لتخطو
طريقة 1 من 2: حساب الكتلة المولية للعنصر
 أوجد الكتلة الذرية النسبية للعنصر. الكتلة الذرية النسبية للعنصر هي المتوسط المرجح ، معبرًا عنه بوحدات الكتلة الذرية (u) ، للكتلة الذرية لجميع النظائر الموجودة بشكل طبيعي. يمكن العثور على هذه المعلومات في الجدول الدوري. كمثال ، الهيدروجين له كتلة ذرية نسبية تساوي 1.008 ؛ كربون 12.0107 ؛ الأكسجين 15.9994 ؛ والكلور 35.453.
أوجد الكتلة الذرية النسبية للعنصر. الكتلة الذرية النسبية للعنصر هي المتوسط المرجح ، معبرًا عنه بوحدات الكتلة الذرية (u) ، للكتلة الذرية لجميع النظائر الموجودة بشكل طبيعي. يمكن العثور على هذه المعلومات في الجدول الدوري. كمثال ، الهيدروجين له كتلة ذرية نسبية تساوي 1.008 ؛ كربون 12.0107 ؛ الأكسجين 15.9994 ؛ والكلور 35.453. 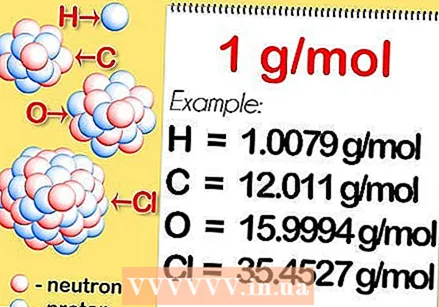 اضرب في الكتلة المولية. يتم تعريف هذا على أنه 1 جرام لكل مول. هذا يحول وحدة الكتلة الذرية إلى جرامات لكل مول ، مما يجعل الكتلة المولية للهيدروجين تساوي 1.008 جرام لكل مول ، وكربون 12.0107 جرام لكل مول ، وأكسجين 15.9994 جرام لكل مول ، وكلور 35.453 جرام لكل مول.
اضرب في الكتلة المولية. يتم تعريف هذا على أنه 1 جرام لكل مول. هذا يحول وحدة الكتلة الذرية إلى جرامات لكل مول ، مما يجعل الكتلة المولية للهيدروجين تساوي 1.008 جرام لكل مول ، وكربون 12.0107 جرام لكل مول ، وأكسجين 15.9994 جرام لكل مول ، وكلور 35.453 جرام لكل مول. - أوجد الكتلة المولية لجزيء ثنائي التكافؤ. يمكن العثور على بعض العناصر فقط في جزيئات 2 أو أكثر. هذا يعني أنك إذا أردت حساب الكتلة المولية لعنصر يتكون ، على سبيل المثال ، من ذرتين ، مثل الهيدروجين والأكسجين والكلور ، فحدد الكتلة الذرية النسبية واضربها في الكتلة المولية ، واضرب نتيجة 2.
- تكون الكتلة المولية لعنصر ما مساوية للكتلة المولية لذرة واحدة مضروبة في عدد الذرات في كل جزيء: في حالة الهيدروجين ، 1.008 في 2 ، أو 2.016 جرام لكل مول ؛ الأكسجين ، 15.9994 مرة 2 ، أو 31.9988 جرامًا لكل مول ؛ ومع الكلور 35.453 × 2 ، أو 70.096 جرامًا لكل مول.
طريقة 2 من 2: حساب الكتلة المولية لمادة مركبة
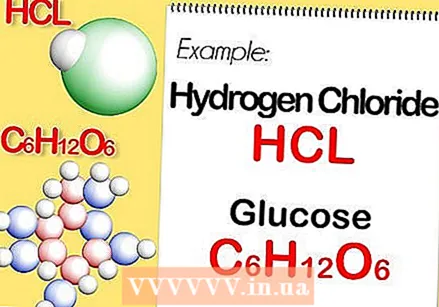 حدد الصيغة الكيميائية للمركب. هذا هو عدد الذرات في كل عنصر من عناصر المركب. (ستجد معلومات حول هذا ، على سبيل المثال ، Binas) على سبيل المثال: صيغة كلوريد الهيدروجين (حمض الهيدروكلوريك) هي HCl ؛ للجلوكوز ج6ح.12ا6. الصيغة الأخيرة تعني أن الجلوكوز يحتوي على 6 ذرات كربون و 12 ذرة هيدروجين و 6 ذرات أكسجين.
حدد الصيغة الكيميائية للمركب. هذا هو عدد الذرات في كل عنصر من عناصر المركب. (ستجد معلومات حول هذا ، على سبيل المثال ، Binas) على سبيل المثال: صيغة كلوريد الهيدروجين (حمض الهيدروكلوريك) هي HCl ؛ للجلوكوز ج6ح.12ا6. الصيغة الأخيرة تعني أن الجلوكوز يحتوي على 6 ذرات كربون و 12 ذرة هيدروجين و 6 ذرات أكسجين. 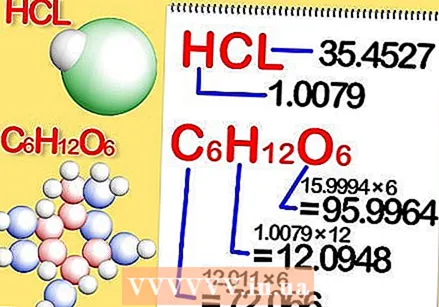 حدد الكتلة المولية لكل عنصر في المركب. اضرب الكتلة الذرية للعنصر في الكتلة المولية وعدد ذرات العنصر في المركب. إليك كيف يعمل ذلك:
حدد الكتلة المولية لكل عنصر في المركب. اضرب الكتلة الذرية للعنصر في الكتلة المولية وعدد ذرات العنصر في المركب. إليك كيف يعمل ذلك: - الكتلة المولية لكل عنصر من كلوريد الهيدروجين ، HCl ، هي 1.008 جرام لكل مول من الهيدروجين و 35.453 جرام لكل مول من الكلور.
- الكتلة المولية لكل عنصر من عناصر الجلوكوز ، C.6ح.12ا6، هي 12.0107 ضرب 6 ، أو 72.0642 جرامًا لكل مول من الكربون ؛ 1.008 ضرب 12 ، أو 12.096 جرامًا لكل مول من الهيدروجين ؛ و 15.9994 مرة 6 ، أو 95.9964 جرامًا لكل مول أكسجين.
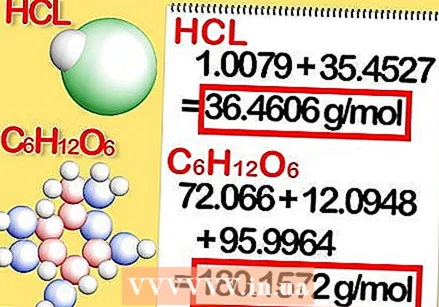 أضف الكتل المولية لكل عنصر في المركب. هذا يعطي الكتلة المولية للمركب. إليك الطريقة:
أضف الكتل المولية لكل عنصر في المركب. هذا يعطي الكتلة المولية للمركب. إليك الطريقة: - الكتلة المولية لكلوريد الهيدروجين هي 1.008 + 35.453 أو 36.461 جرام لكل مول.
- الكتلة المولية للجلوكوز هي 72.0642 + 12.096 + 95.9964 ، أو 180.1566 جرام لكل مول.
نصائح
- بينما في معظم الحالات ، يكون للكتل الذرية النسبية دقة 4 منازل عشرية ، في المختبر دقة من منزلتين عشريتين أو أقل تنطبق على الكتل الكبيرة بشكل استثنائي. في المختبر ، الكتلة المولية لكلوريد الهيدروجين هي 36.46 جرام لكل مول و تلك للجلوكوز 180.16 جرام لكل مول.
تحذيرات
- لا تخلط بين الكتلة المولية والكتلة الجزيئية. الأخير هو كتلة الجزيء الفردي لعنصر أو مركب. يمكن فهم الكتلة المولية على أنها متوسط الكتلة لجميع الجزيئات في عينة من مادة معينة ، تمامًا كما أن الكتلة الذرية النسبية هي متوسط الكتل الذرية لجميع النظائر.
الضرورات
- Binas والجدول الدوري للعناصر
- آلة حاسبة



