مؤلف:
Lewis Jackson
تاريخ الخلق:
5 قد 2021
تاريخ التحديث:
1 تموز 2024

المحتوى
مول هو وحدة القياس القياسية في الكيمياء ، وتستخدم للنظر في العناصر المختلفة في المركب. عادة ما يتم حساب الكتلة المركبة بالجرام (جم) ويجب تحويلها إلى وحدات مولية. الانتقال بسيط للغاية ، ومع ذلك ، لا تزال هناك بعض الخطوات المهمة التي يتعين علينا اتباعها. باستخدام الطريقة أدناه ، يمكنك بسهولة تحويل الجرام إلى مولات.
خطوات
جزء 1 من 2: حساب الكتلة الجزيئية
تجهيز المستلزمات اللازمة لحل مسألة الرياضيات. عندما تتوفر لديك جميع الأدوات ، سيكون من الأسهل حل المشكلة. ما تحتاجه هو:
- قلم رصاص وورقة. تصبح الرياضيات أسهل عندما تكتب كل شيء على الورق. تحتاج إلى تقديم جميع الخطوات للوصول إلى الدرجة القصوى.
- الجدول الدوري للعناصر الكيميائية: يستخدم لتحديد كتلة ذرات العناصر.
- حاسبة الجيب: تستخدم لحساب الأرقام المعقدة.

حدد العناصر الموجودة في المركب التي تريد تحويلها إلى وحدات مولية. الخطوة الأولى في حساب الكتلة الجزيئية هي تحديد العناصر المكونة للمركب. هذا سهل لأن اختصار العناصر يتكون من حرف إلى حرفين فقط.- إذا تم اختصار مادة بحرفين ، فسيتم تكبير الحرف الأول والحرف الثاني بحروف صغيرة. مثال: Mg هو اختصار لعنصر المغنيسيوم.
- مركبات ناهكو3 يتكون من أربعة عناصر: الصوديوم (Na) والهيدروجين (H) والكربون (C) والأكسجين (O).
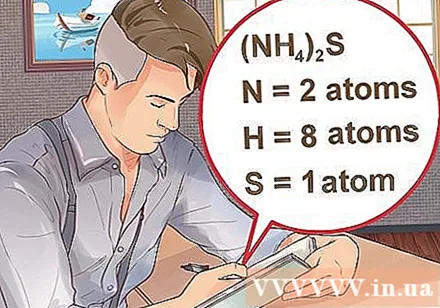
حدد عدد الذرات لكل عنصر في المركب. تحتاج إلى معرفة العدد الذري لكل مادة في مركب لحساب كتلة جزيء هذا المركب. يمثل الرقم الصغير بجوار اختصار العنصر العدد الذري للعنصر.- مثال: مركب H2يحتوي O على ذرتين من الهيدروجين وذرة أكسجين واحدة.
- إذا كان المركب مكتوبًا بين قوسين ، مصحوبًا بمؤشر صغير ، فهذا يعني أن كل مكون بين قوسين يضاعف الفهرس. مثال: مركب (NH4)2يتكون S من ذرتين N ، وثماني ذرات H وذرة S.

اكتب الورقة الذرية المكعبة لكل عنصر. يعد استخدام الجدول الدوري أسهل طريقة لإيجاد الذرة المكعبة لعنصر ما. بعد تحديد موقع العنصر في الجدول الدوري ، سترى الكتلة الذرية أسفل رمز العنصر مباشرةً.- على سبيل المثال ، ذرة الأكسجين المكعبة تساوي 15.99.
احسب الكتلة الجزيئية. يساوي جزيء كتلة مادة ما عدد ذرات كل عنصر مضروبًا في ذرة كتلة ذلك العنصر. هذه الكمية ضرورية في الجرام للتحويل المولي.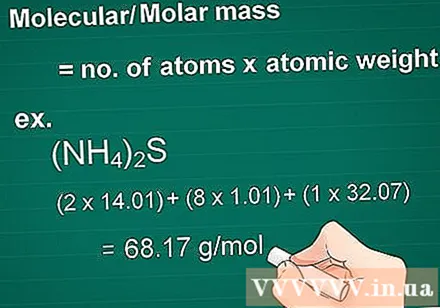
- أولًا ، اضرب العدد الذري لكل عنصر في المركب في ذرة كتلته.
- ثم اجمع كتل العناصر في المركب معًا.
- مثال: الكتلة الجزيئية لمركب (NH4)2S = (2 × 14.01) + (8 × 1.01) + (1 × 32.07) = 68.17 جم / مول.
- تُعرف الكتلة الجزيئية أيضًا باسم الكتلة المولية.
جزء 2 من 2: تحويل الجرام إلى مول
قم بإعداد صيغة التحويل. لإيجاد عدد مولات المركب ، اقسم عدد جرامات المركب على الكتلة المولية لذلك المركب.
- الصيغة: عدد المولات = الكتلة (جرام) / الكتلة المولية للمركب (جرام / مول)
عوّض بالأرقام في الصيغة. بعد إعداد الصيغة الصحيحة ، فإن الخطوة التالية هي استبدال الأرقام التي حسبتها في الصيغة. إذا كنت تريد التأكد من أن البيانات في الموضع الصحيح ، فيمكنك التحقق منها عن طريق إخماد الوحدة. إذا كانت الوحدة المتبقية بعد البساطة هي الشامات ، فأنت مضبوط بشكل صحيح.
حل المعادلة. باستخدام الآلة الحاسبة ، اقسم الكتلة على الجزيء المكعب للمادة أو المركب. سيكون حاصل القسمة هو عدد مولات المادة أو المركب الذي تبحث عنه.
- على سبيل المثال ، تكمن المشكلة في 2 جرام من الماء (H.2O) واطلب منك تحويلها إلى وحدات مولارية. لدينا الكتلة المولية لـ H2O هو 18 جم / مول. قسّم 2 على 18 لتحصل على 0.1111 مول H2O.
النصيحة
- لا تنس تضمين العنصر أو الاسم المركب مع الإجابات.
- إذا طُلب منك تقديم تمرين أو اختبار ، فتأكد من إظهار إجاباتك بوضوح عن طريق الدوران أو رسم مربع حول الإجابات.
ماذا تحتاج
- الجدول الدوري الكيميائي
- قلم
- ورق
- الحاسوب
- مشاكل الكيمياء