مؤلف:
Roger Morrison
تاريخ الخلق:
8 شهر تسعة 2021
تاريخ التحديث:
1 تموز 2024
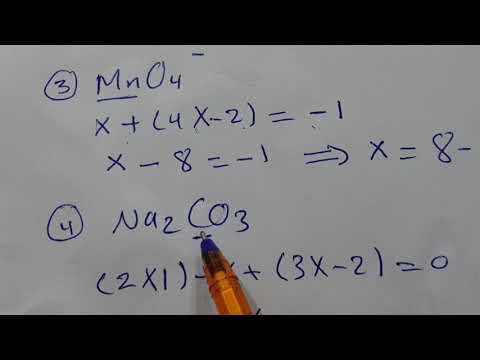
المحتوى
- لتخطو
- جزء 1 من 2: تعيين أعداد الأكسدة بناءً على القواعد الكيميائية
- جزء 2 من 2: تخصيص أعداد للذرات بدون قواعد أعداد الأكسدة
- نصائح
- الضرورات
في الكيمياء ، تعني مصطلحات "الأكسدة" و "الاختزال" تلك التفاعلات التي تفقد فيها الذرة (أو مجموعة الذرات) أو تكتسب إلكترونات ، على التوالي. أرقام الأكسدة هي أرقام مخصصة للذرات (أو مجموعات الذرات) لمساعدة الكيميائيين في التحكم في عدد الإلكترونات المتاحة للتهجير وما إذا كانت المواد المتفاعلة تتأكسد أو تنقص أثناء التفاعل. يمكن أن تتراوح عملية تعيين أعداد الأكسدة للذرات من بسيطة جدًا إلى أكثر تعقيدًا ، اعتمادًا على شحنة الذرات والتركيب الكيميائي للجزيئات التي تشكل جزءًا منها. لجعل الأمور أكثر تعقيدًا ، يمكن أن تحتوي بعض الذرات على أعداد أكسدة متعددة. لحسن الحظ ، فإن تعيين أرقام الأكسدة محكوم بقواعد محددة بوضوح وسهلة المتابعة ، لكن الفهم الأساسي للكيمياء والجبر سيجعل استخدام هذه القواعد أسهل كثيرًا.
لتخطو
جزء 1 من 2: تعيين أعداد الأكسدة بناءً على القواعد الكيميائية
 حدد ما إذا كانت المادة المعنية عنصرية. تحتوي الذرات الحرة غير المقيدة دائمًا على عدد أكسدة يساوي 0. وهذا صحيح لكل من الذرات التي تتكون من ذرة واحدة والذرات التي يكون شكلها الأولي ثنائي الذرة أو متعدد الذرات.
حدد ما إذا كانت المادة المعنية عنصرية. تحتوي الذرات الحرة غير المقيدة دائمًا على عدد أكسدة يساوي 0. وهذا صحيح لكل من الذرات التي تتكون من ذرة واحدة والذرات التي يكون شكلها الأولي ثنائي الذرة أو متعدد الذرات. - على سبيل المثال ، Al(س) و Cl2 كلاهما يحتوي على عدد أكسدة 0 لأنهما ليسا ذرات مركبة.
- لاحظ أن الكبريت في شكله الأولي ، S.8 (octasulfur) ، على الرغم من عدم انتظامه ، إلا أنه يحتوي أيضًا على عدد أكسدة قدره 0.
 حدد ما إذا كانت المادة المعنية أيونًا. الأيونات لها أعداد أكسدة تساوي شحنتها. هذا صحيح بالنسبة للأيونات غير المربوطة وكذلك الأيونات التي تشكل جزءًا من أيون مركب.
حدد ما إذا كانت المادة المعنية أيونًا. الأيونات لها أعداد أكسدة تساوي شحنتها. هذا صحيح بالنسبة للأيونات غير المربوطة وكذلك الأيونات التي تشكل جزءًا من أيون مركب. - على سبيل المثال ، يحتوي أيون Cl على عدد أكسدة -1.
- كلون لا يزال لديه عدد الأكسدة -1 عندما يكون جزءًا من مركب NaCl. نظرًا لأن أيون Na ، بحكم تعريفه ، له شحنة +1 ، فنحن نعلم أن شحنة أيون الكلور لها -1 ، وبالتالي فإن عدد الأكسدة لا يزال -1.
 في حالة أيونات المعادن ، من الجيد أن نتذكر أن عدد الأكسدة المتعددة ممكن. يمكن أن تحتوي العديد من المعادن على أكثر من هبوط واحد. على سبيل المثال ، يمكن أن يكون الحديد المعدني (Fe) عبارة عن أيون بشحنة +2 أو +3. يمكن تحديد شحنة أيونات المعادن (وبالتالي أعداد الأكسدة الخاصة بها) فيما يتعلق بشحنة الذرات الأخرى في تكوينها ، أو عند كتابتها كنص ، عن طريق التدوين بالأرقام الرومانية (مثل في الجملة: "أيون الحديد (III) له شحنة +3.").
في حالة أيونات المعادن ، من الجيد أن نتذكر أن عدد الأكسدة المتعددة ممكن. يمكن أن تحتوي العديد من المعادن على أكثر من هبوط واحد. على سبيل المثال ، يمكن أن يكون الحديد المعدني (Fe) عبارة عن أيون بشحنة +2 أو +3. يمكن تحديد شحنة أيونات المعادن (وبالتالي أعداد الأكسدة الخاصة بها) فيما يتعلق بشحنة الذرات الأخرى في تكوينها ، أو عند كتابتها كنص ، عن طريق التدوين بالأرقام الرومانية (مثل في الجملة: "أيون الحديد (III) له شحنة +3."). - على سبيل المثال ، دعنا نلقي نظرة فاحصة على مركب يحتوي على أيون الألومنيوم. مجمع AlCl3 شحنة تساوي 0. نظرًا لأننا نعلم أن أيونات الكلورين لها شحنة مقدارها -1 و 3 أيونات كلوريد موجودة في المركب ، يجب أن يكون للأيون شحنة +3 ، بحيث تكون شحنة جميع الأيونات المضافة معًا 0. لذا ، فإن عدد أكسدة Al هو +3.
 حدد عدد الأكسدة -2 للأكسجين (مع استثناءات). في تقريبيا في جميع الحالات ، تحتوي ذرات الأكسجين على عدد أكسدة -2. هناك بعض الاستثناءات لهذه القاعدة:
حدد عدد الأكسدة -2 للأكسجين (مع استثناءات). في تقريبيا في جميع الحالات ، تحتوي ذرات الأكسجين على عدد أكسدة -2. هناك بعض الاستثناءات لهذه القاعدة: - عندما يكون الأكسجين في الحالة الأولية (O2) ، فإن عدد الأكسدة يساوي 0 ، وهذا هو الحال بالنسبة لجميع الذرات الأولية.
- عندما يكون الأكسجين جزءًا من بيروكسيد ، ثم عدد الأكسدة هو -1. البيروكسيدات هي فئة من المركبات التي لها رابطة أكسجين وأكسجين (أو أنيون البيروكسيد O2). على سبيل المثال ، في جزيء H2ا2 (بيروكسيد الهيدروجين) ، يحتوي الأكسجين على عدد أكسدة (وشحنة) -1 ، أيضًا عندما يكون الأكسجين جزءًا من أكسيد فائق ، يكون رقم الأكسدة -0.5.
- عندما يرتبط الأكسجين بالفلور ، يكون رقم الأكسدة +2. راجع قاعدة الفلور أدناه لمزيد من المعلومات. انا لا2F.2) هذا هو +1.
 عيّن عدد أكسدة +1 للهيدروجين (مع استثناءات). كما هو الحال مع الأكسجين ، يعتمد عدد أكسدة الهيدروجين على حالات استثنائية. بشكل عام ، يحتوي الهيدروجين على رقم أكسدة +1 (باستثناء الشكل الأولي ، H.2). ولكن في حالة وجود مركب خاص يسمى الهجينة ، يحتوي الهيدروجين على عدد أكسدة -1.
عيّن عدد أكسدة +1 للهيدروجين (مع استثناءات). كما هو الحال مع الأكسجين ، يعتمد عدد أكسدة الهيدروجين على حالات استثنائية. بشكل عام ، يحتوي الهيدروجين على رقم أكسدة +1 (باستثناء الشكل الأولي ، H.2). ولكن في حالة وجود مركب خاص يسمى الهجينة ، يحتوي الهيدروجين على عدد أكسدة -1. - على سبيل المثال ، من H2أوه ، نحن نعلم أن عدد الأكسدة للهيدروجين +1 لأن شحنة الأكسجين تساوي -2 ونحتاج إلى شحنتين +1 لنصنع مركبًا بشحنة كلية تساوي صفرًا. ولكن مع مادة هيدريد الصوديوم ، NaH ، يحتوي الهيدروجين على عدد أكسدة -1 لأن شحنة أيون الصوديوم هي +1 ، ولجعل الشحنة الكلية للمركب 0 ، يحتوي الهيدروجين على شحنة (وبالتالي عدد أكسدة) من -1.
 الفلور دائما عدد الأكسدة -1. كما هو موضح أعلاه ، يمكن أن تختلف أعداد الأكسدة لعناصر معينة بسبب عوامل مختلفة (أيونات المعادن ، وذرات الأكسجين في البيروكسيدات ، وما إلى ذلك). من ناحية أخرى ، يحتوي الفلور على عدد أكسدة -1 ، وهذا لا يتغير أبدًا. هذا لأن الفلور هو العنصر الأكثر سلبية كهربيًا ، أو بعبارة أخرى ، هو العنصر الأقل استعدادًا للتخلي عن الإلكترونات والأرجح أن يستحوذ على الإلكترونات من الذرات الأخرى. لذلك ، لن يتغير رقم الأكسدة.
الفلور دائما عدد الأكسدة -1. كما هو موضح أعلاه ، يمكن أن تختلف أعداد الأكسدة لعناصر معينة بسبب عوامل مختلفة (أيونات المعادن ، وذرات الأكسجين في البيروكسيدات ، وما إلى ذلك). من ناحية أخرى ، يحتوي الفلور على عدد أكسدة -1 ، وهذا لا يتغير أبدًا. هذا لأن الفلور هو العنصر الأكثر سلبية كهربيًا ، أو بعبارة أخرى ، هو العنصر الأقل استعدادًا للتخلي عن الإلكترونات والأرجح أن يستحوذ على الإلكترونات من الذرات الأخرى. لذلك ، لن يتغير رقم الأكسدة.  أعداد الأكسدة في المركب تساوي شحنة المركب. إن أعداد الأكسدة لجميع الذرات في المركب تساوي شحنة هذا المركب. على سبيل المثال ، إذا لم يكن للمركب شحنة ، فسيكون مجموع جميع أرقام الأكسدة صفرًا ؛ إذا كان المركب عبارة عن أيون متعدد الذرات بشحنة -1 ، فيجب أن تكون أرقام الأكسدة المضافة -1 ، إلخ.
أعداد الأكسدة في المركب تساوي شحنة المركب. إن أعداد الأكسدة لجميع الذرات في المركب تساوي شحنة هذا المركب. على سبيل المثال ، إذا لم يكن للمركب شحنة ، فسيكون مجموع جميع أرقام الأكسدة صفرًا ؛ إذا كان المركب عبارة عن أيون متعدد الذرات بشحنة -1 ، فيجب أن تكون أرقام الأكسدة المضافة -1 ، إلخ. - هذه طريقة جيدة للتحقق من إجابتك - إذا كانت أرقام الأكسدة المضافة لمركب لا تساوي شحنة هذا المركب ، فأنت تعلم أنك قد ارتكبت خطأ.
جزء 2 من 2: تخصيص أعداد للذرات بدون قواعد أعداد الأكسدة
 ابحث عن الذرات بدون قواعد عدد الأكسدة. بعض الذرات لا تتبع قواعد إيجاد أعداد الأكسدة. إذا كانت الذرة لا تمتثل للقواعد المذكورة أعلاه ولم تكن متأكدًا من شحنتها (على سبيل المثال ، إذا كانت جزءًا من مركب أكبر بحيث تكون الشحنة الفردية غير معروفة) ، فيمكنك العثور على عدد أكسدة تلك الذرة عن طريق إزالة. أولاً تحدد ماهية أكسدة كل ذرة أخرى في المركب. ثم تقوم بحل مجموع المجهول في المعادلة بناءً على إجمالي شحنة المركب.
ابحث عن الذرات بدون قواعد عدد الأكسدة. بعض الذرات لا تتبع قواعد إيجاد أعداد الأكسدة. إذا كانت الذرة لا تمتثل للقواعد المذكورة أعلاه ولم تكن متأكدًا من شحنتها (على سبيل المثال ، إذا كانت جزءًا من مركب أكبر بحيث تكون الشحنة الفردية غير معروفة) ، فيمكنك العثور على عدد أكسدة تلك الذرة عن طريق إزالة. أولاً تحدد ماهية أكسدة كل ذرة أخرى في المركب. ثم تقوم بحل مجموع المجهول في المعادلة بناءً على إجمالي شحنة المركب. - على سبيل المثال ، في المركب Na2وبالتالي4، شحنة الكبريت (S) غير معروفة - إنها ليست في شكلها الأولي ، لذا فهي ليست 0 ، لكن هذا كل ما نعرفه. هذا مرشح جيد لتطبيق هذه الطريقة لتحديد رقم الأكسدة جبريًا.
 أوجد أعداد الأكسدة المعروفة للعناصر الأخرى في المركب. باستخدام قواعد تخصيص رقم الأكسدة ، نحدد عدد الأكسدة الذي تمتلكه الذرات الأخرى في المركب. انتبه إلى الاستثناءات مثل O و H وما إلى ذلك.
أوجد أعداد الأكسدة المعروفة للعناصر الأخرى في المركب. باستخدام قواعد تخصيص رقم الأكسدة ، نحدد عدد الأكسدة الذي تمتلكه الذرات الأخرى في المركب. انتبه إلى الاستثناءات مثل O و H وما إلى ذلك. - في نا2وبالتالي4، نعلم ، بناءً على مجموعة القواعد لدينا ، أن أيون الصوديوم له شحنة (وبالتالي عدد أكسدة) +1 وأن ذرات الأكسجين تحتوي على عدد أكسدة -2.
 اضرب عدد كل ذرة في عدد الأكسدة. الآن بعد أن عرفنا أعداد الأكسدة لجميع الذرات باستثناء المجهول ، علينا أن نأخذ في الاعتبار أن بعض هذه الذرات قد تحدث أكثر من مرة. اضرب كل معامل (مكتوب بخط منخفض بعد رمز الذرة في المركب) في رقم الأكسدة.
اضرب عدد كل ذرة في عدد الأكسدة. الآن بعد أن عرفنا أعداد الأكسدة لجميع الذرات باستثناء المجهول ، علينا أن نأخذ في الاعتبار أن بعض هذه الذرات قد تحدث أكثر من مرة. اضرب كل معامل (مكتوب بخط منخفض بعد رمز الذرة في المركب) في رقم الأكسدة. - أما بالنسبة لنا2وبالتالي4، نعلم أن هناك 2 ذرات Na و 4 ذرات O. الآن نقوم بالحسابات التالية ، 2 × +1 ، للحصول على عدد أكسدة Na ، 2 ، ونضرب 4 × -2 ، رقم أكسدة O ، -8.
 اجمع النتائج. جمع نتائج هذه المضاعفات يعطي رقم أكسدة المركب ، بدون مع الأخذ بعين الاعتبار عدد الأكسدة للذرة المجهولة.
اجمع النتائج. جمع نتائج هذه المضاعفات يعطي رقم أكسدة المركب ، بدون مع الأخذ بعين الاعتبار عدد الأكسدة للذرة المجهولة. - في مثالنا مع Na2وبالتالي4، نضيف 2 إلى -8 لنحصل على -6.
 احسب عدد الأكسدة المجهول بناءً على شحنة المركب. لديك الآن جميع البيانات للعثور على عدد الأكسدة المجهول باستخدام بعض الجبر البسيط. سنستخدم المعادلة والإجابة من الخطوة السابقة ، بالإضافة إلى شحنة المركب. بعبارات أخرى: (مجموع أرقام الأكسدة غير المعروفة) + (رقم الأكسدة المجهول الذي تريد معرفته) = (شحنة المركب).
احسب عدد الأكسدة المجهول بناءً على شحنة المركب. لديك الآن جميع البيانات للعثور على عدد الأكسدة المجهول باستخدام بعض الجبر البسيط. سنستخدم المعادلة والإجابة من الخطوة السابقة ، بالإضافة إلى شحنة المركب. بعبارات أخرى: (مجموع أرقام الأكسدة غير المعروفة) + (رقم الأكسدة المجهول الذي تريد معرفته) = (شحنة المركب).- في مثال نا2وبالتالي4، نحل هذا على النحو التالي:
- (مجموع أرقام الأكسدة المعروفة) + (رقم الأكسدة غير المعروف الذي تريد حله) = (شحنة المركب)
- -6 + S = 0
- S = 0 + 6
- S = 6. S لها رقم أكسدة أو 6 في نا2وبالتالي4.
- في مثال نا2وبالتالي4، نحل هذا على النحو التالي:
نصائح
- تحتوي الذرات في شكلها الأساسي دائمًا على عدد أكسدة يساوي 0. أيون يتكون من ذرة واحدة له عدد أكسدة مساوٍ للشحنة. معادن المجموعة 1 أ مثل الهيدروجين والليثيوم والصوديوم لها رقم أكسدة +1 ؛ تحتوي معادن المجموعة 2 أ ، مثل المغنيسيوم والكالسيوم ، على عدد أكسدة +2. يمكن أن يكون لكل من الهيدروجين والأكسجين رقمان مختلفان من الأكسدة ، اعتمادًا على الرابطة بينهما.
- في المركب ، يجب أن يكون مجموع جميع أرقام الأكسدة مساويًا لـ 0. إذا كان هناك أيون به ذرتان ، فيجب أن يكون مجموع أرقام الأكسدة مساويًا لشحنة الأيون.
- من المفيد جدًا معرفة كيفية قراءة الجدول الدوري ومكان العثور على المعادن واللافلزات.
الضرورات
- الجدول الدوري للعناصر
- اتصال بالإنترنت
- كتاب كيمياء
- ورق أو قلم أو قلم رصاص
- آلة حاسبة